机构名称:
¥ 2.0
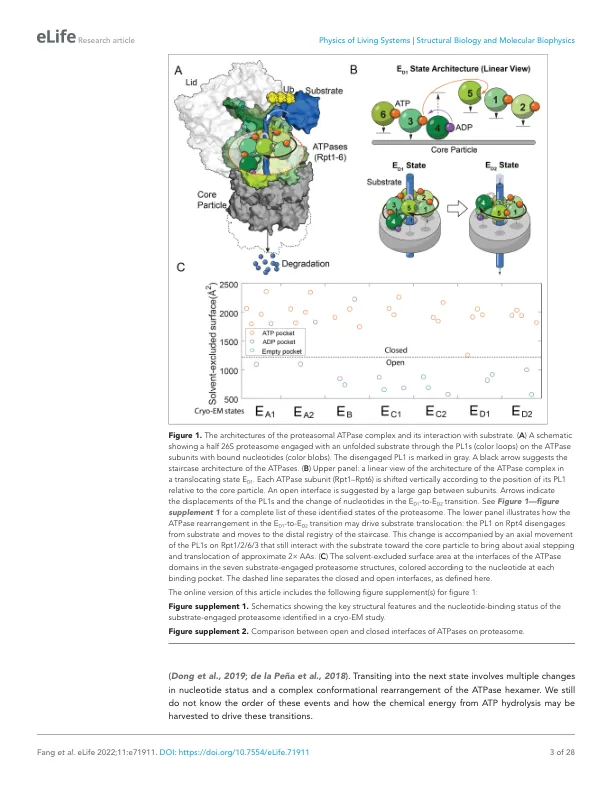
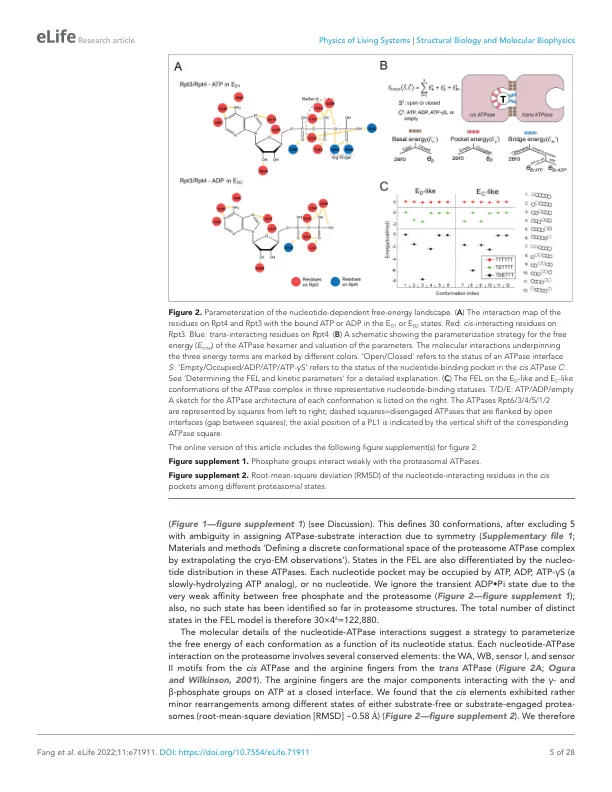
摘要 AAA+ 家族中的环状 ATPase 复合物执行多种细胞功能,这些功能需要其各个 ATPase 亚基的构象转变之间的协调(Erzberger 和 Berger,2006 年;Puchades 等人,2020 年)。如何通过这些协调运动捕获 ATP 水解产生的能量来做机械功尚不清楚。在本研究中,我们开发了一种新方法,用于基于互补的结构和动力学测量来描绘蛋白酶体异六聚体 ATPase 复合物的核苷酸依赖性自由能景观 (FEL)。我们使用 FEL 模拟蛋白酶体的动力学并定量评估预测的结构和动力学特性。FEL 模型预测与本研究和以前研究中的广泛实验观察结果一致,并提出了蛋白酶体 ATPase 的新型机制特征。我们发现 ATPase 亚基的协同运动源自 ATPase 六聚体的设计,该设计要求每个核苷酸结合状态具有独特的最小自由能。ATP 水解通过触发 ATPase 复合物的能量耗散构象转变来决定底物转位的方向。
经验能量图谱揭示蛋白酶体在多肽转运中的机制
主要关键词